Selection of free-living nitrogen fixing bacteria to promote on rice growth
Keywords:
Nitrogen fixing bacteria, rice rhizosphere soil, bio-fertilizerAbstract
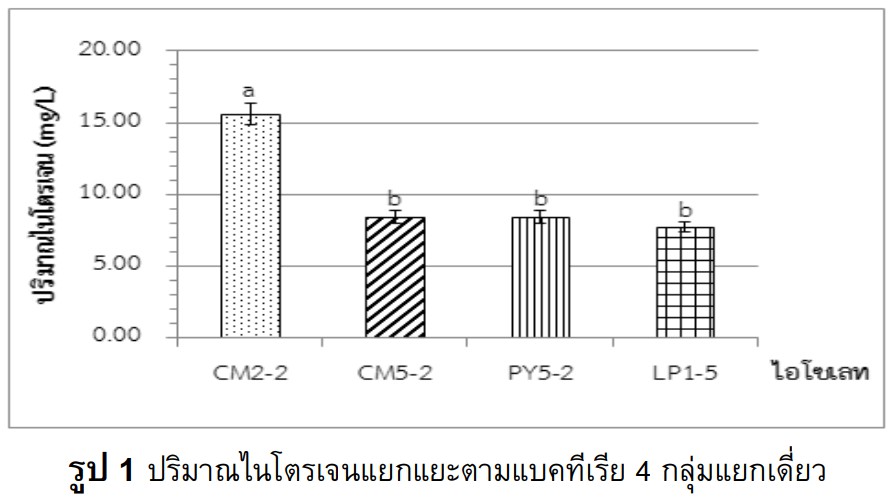
The study was aimed to isolate the bacteria from rice rhizosphere soil samples, and selected the freeliving nitrogen fixing bacteria. There were totally 310 isolates with 26 isolates for nitrogen fixing bacteria. The qualification testing showed 10 bacterial isolates, with the high effectiveness of nitrogen fixation and indole-3- acetic acid (IAA) production. Identification of selected bacteria using analyzing the 16S rRNA genes sequence indicated three species such as Bacillus altitudinis CM2-2, Bacillus aryabhattai LP1-5 and Pseudomonas nitroreducens PY7-6, which had produced high nitrogen compounds at 15.60 ± 0.40, 7.70 ± 0.70 and 6.30 ± 0.10 mg/L respectively. Beside, Pseudomonas nitroreducens PY7-6 had provided the highest amount of IAA at 23.90 ± 0.20 mg/L. The NPK chemical fertilizer and isolated bacteria had been applied into the rice pot during the 30-day seedling period. The NPK and Bacillus altitudinis CM2-2 was the most treatment for the rice growth including the stem height, root length, leaf number, and fresh and dry weight, significant differences compared with the control. However, there was no significant difference of the nitrogen contents. In conclusion, Bacillus altitudinis CM2-2 might be developed as bio-fertilizer.
References
2. Osotsapar Y. Plant Nutrient. Bangkok: Kasetsart University Press; 2009.
3. Magrin G, García CG, Choque DC, Giménez JC, Moreno AR, Nagy GJ, et al. Latin America. Climate change 2007: Impacts, adaptation and vulnerability. Contribution of working Group II to the fourth assessment report of the intergovernmental panel on climate change. In: Parry ML, Canziani OF, Palutikof JP, van der Linden PJ, Hanson CE, editors. Cambridge: Cambridge University Press; 2007. p. 581-615.
4. Feng Y, Shen D, Song W. Rice endophyte Pantoea agglomerans YS19 promotes host plant growth and affects allocations of host photosynthates. J Appl microbial. 2006;100(5):938-945
5. Glick BR, Bashan Y. Genetic manipulation of plant growth-promoting bacteria to enhance biocontrol of phytopathogens. Biotechnol Adv. 1997;15(2):353-378.
6. Laskar F, Sharma GD. Isolation and characterisation of Diazotrophic bacteria from rhizosphere of different rice cultivars of south Assam, India. Curr World Environ. 2013;8(1):157-163.
7. Slavov S, Van Onckelen H, Batchvarova R, Atanassov A, Prinsen E. IAA production during germination of Orobanche spp. Seeds. J Plant Physiol. 2004;161(7):847-853.
8. San-Francisco S, Houdusse F, Zamarreño AM, Garnica M, Casanova E, García-Mina JM. Effects of IAA and IAA precursors on the development, mineral nutrition, IAA content and free polyamine content of pepper plants cultivated in hydroponic conditions. Sci Hortic. 2005;106(1):38-52.
9. Khan MM, Khatun A, Islam MT. Promotion of plant growth by phytohormone producing bacteria. In: Garg N, Aeron A, editors. Microbes in Action. USA: Nova Science Publishers; 2016. p. 45-76.
10. Davies PJ. Plant hormones and their role in plant growth and development. The Netherland: Dordrecht; 1990.
11. Bal HB, Nayak L, Das S, Adhya TK. Isolation of ACC deaminase producing PGPR from rice rhizosphere and evaluating their plant growth promoting activity under salt stress. Plant Soil. 2013;366(1-2):93-105.
12. Lavakush Yadav J, Verma JP, Jaiswal KD, Kumar A. Evaluation of PGPR and different concentration of phosphorus level on plant growth, yield and nutrient uptake of rice (Oryzasativa). Ecol Eng. 2014;62:123-128.
13. Thazin NA, Nourmohammadi S, Sunitha EM, Myint M. Isolation of endophyticbacteria from green gram and study on their plant growth promoting activities. Inter J Appl Biol Phar Technol. 2011;2(3):525-537.
14. Bashir A, Midrarullah, Mirza MS. Effects of inoculation with plant growth promotingrhizobacteria (PGPRs) on different growth parametersof cold area rice variety, Fakremalakand. Afr J Microbiol Res. 2013;7(17):1651-1656.
15. Babalola OO. Beneficial bacteria of agricultural importance. Biotechnol Lett. 2010;32(11):1559-1570.
16. Dobereiner J, Marriel IE, Nery M. Ecological distribution of Spirillum lipoferum Beijerinck. Can Microbiol. 1976;22(10):1464-1473.
17. Ahmad F, Ahmad I, Khan MS. Screening of free-living rhizospheric bacteria for their multiple plant growth promotion activities. Microbiol Research. 2008;163(2):173-181.
18. Bharucha U, Patel K, Trivedi UB. Optimization of indole acetic acid production by Pseudomonas putida UB1 and its effect as plant growth-promoting rhizobacteria on mustard (Brassica nigra). Agri Res. 2013;2(23): 215-221.
19. Ahmad M, Nangyal H, Imran M, Ullah F. Optimization of protocol for surface sterilization and callus induction for three rice varieties. Am-Eurasian J Agri Environ Sci. 2016;16(2):357-361.
20. Division of Rice Research and Development Rice department. Planting, maintenance and fertilizer use in rice fields. [Internet]. 2012 [cited 2014 Nov 21]. Available from: http://www.ricethailand.go.th/Rkb/management/ index.php.htm
Downloads
Published
How to Cite
Issue
Section
License
ผู้นิพนธ์ต้องรับผิดชอบข้อความในบทนิพนธ์ของตน มหาวิทยาลัยพะเยาไม่จำเป็นต้องเห็นด้วยกับบทความที่ตีพิมพ์เสมอไป ผู้สนใจสามารถคัดลอก และนำไปใช้ได้ แต่จะต้องขออนุมัติเจ้าของ และได้รับการอนุมัติเป็นลายลักษณ์อักษรก่อน พร้อมกับมีการอ้างอิงและกล่าวคำขอบคุณให้ถูกต้องด้วย
The authors are themselves responsible for their contents. Signed articles may not always reflect the opinion of University of Phayao. The articles can be reproduced and reprinted, provided that permission is given by the authors and acknowledgement must be given.







