Efficacy of pomegranate peel extracts in prostate cancer cells
Keywords:
Pomegranate, Phenolic content, Radical scavenging activity, Prostate cancerAbstract
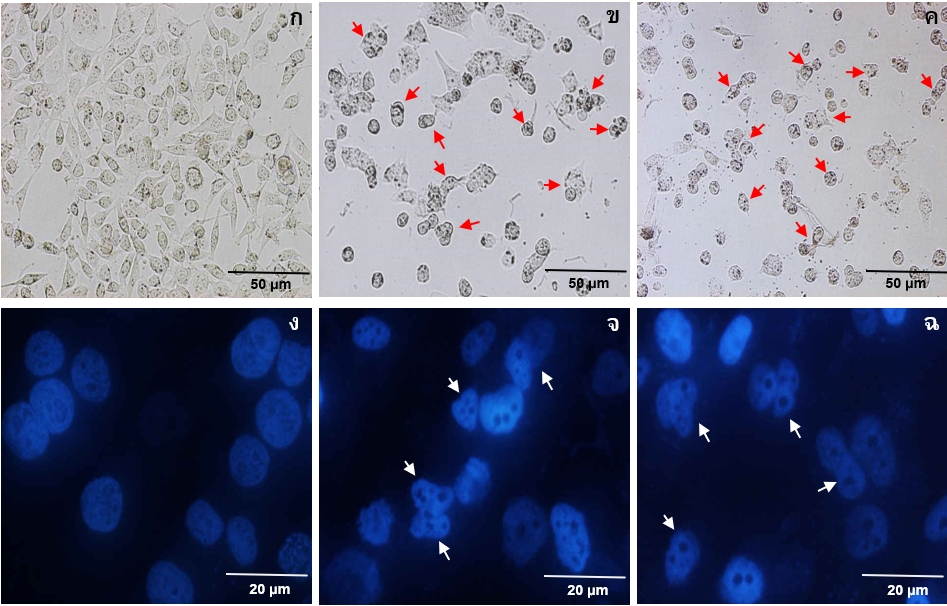
Prostate cancer is one of the most common cancers in males and trouble to treat. Also, the treatment takes high cost and has side effects on patients sometimes. Therefore, medicinal plants are a suitable choice for the treatment of prostate cancer. The objective of this study was to evaluate the total phenolic content of pomegranate peel extracts and their antioxidant activity. In addition, the growth inhibitory effect, the morphological changes, and the nuclear condensation of PC-3 prostate cancer cells were required to study for determining the potential of peel extracts. The result found that the total phenolic content of peel ethanolic extract (PE/e) was higher than peel water extract (PE/w) (428.03 > 362.47 µg GAE/mg, respectively). Corresponding to an ability of median ABTS radical scavenging concentration (EC50), PE/e (129.20 µg/mL) was grateful over than PE/w (151.27 µg/mL) by the ability was similarly to catechin (128.91 µg/mL) but less than epigallocatechin-3-gallate (71.05 µg/mL). Catechin and epigallocatechin-3-gallate both are positive control. For inhibiting the growth of PC-3 cancer cells though median inhibitory concentration (IC50), it found that PE/e (455.63 µg/mL) was more potent than PE/w (685.98 µg/mL) by both extracts could inhibit cancer cells better than catechin (897.12 µg/mL) but lower than epigallocatechin-3-gallate (180.42 µg/mL). Moreover, both extracts could induce morphological changes and nuclear condensation of PC-3 cells. In conclusion, the pomegranate peel extracts had high phenolic contents and the great potential of antioxidation. Also, the peel extracts had a dominant effect on PC-3 cells antiproliferation.
References
Pinter O, Mucsi I, Molna J. In vitro antiproliferation in prostate cancer cell lines with cytostatics and combinations with resistance modifiers. in vivo. 2005;19:253-260.
Haskell CM. Principles of cancer chemotherapy. In: Cancer Treatment. 2 nd ed. Haskell CM., (ed). Philadelphia: WB. Saunders. p. 21-42.
Ganry O. Phytoestrogens and prostate cancer risk. Prev Med. 2005;41:1-6.
Morton MS, Chan PS, Cheng C, Blacklock N, Matos-Ferreira A, Abranches-Monteiro L, et al. Lignans and isoflavonoids in plasma and prostatic fluid in men: samples from Portugal, Hong Kong, and the United Kingdom. Prostate. 1997;32:122-128.
Adlercreutz H, Markkanen H, Watanabe S. Plasma concentrations of phyto-oestrogens in Japanese men. Lancet. 1993;342:1209-1210.
Parkin DM, Bray F, Ferlay J, Pisani P. Global cancer statistics, 2002. CA Cancer J Clin. 2005;55:74-108.
Knekt P, Kumpulainen J, Jarvinen R, Rissanen H, Heliovaara M, Reunanen A, et al. Flavonoid intake and risk of chronic diseases. Am J Clin Nutr. 2002;76:560-568.
Neuhouser ML. Dietary flavonoids and cancer risk: evidence from human population studies. Nutr Cancer. 2004;50:1-7.
Lee MM, Gomez SL, Chang JS, Wey M, Wang RT, Hsing AW. Soy and isoflavone consumption in relation to prostate cancer risk in China. Cancer Epidemiol Biomarkers Prev. 2003;12:665-668.
Morton JF. Fruits of warm climates. 1987. Miami: FL. p. 352-355.
Lansky EP, Newman RA. Punica granatum (pomegranate) and its potential for prevention and treatment of inflammation and cancer. J Ethnopharmacol. 2007;109:177-206.
de Pascual-Teresa S, Santos-Buelga C, Rivas-Gonzalo JC. Quantitative analysis of flavan-3-ols in Spanish foodstuffs and beverages. J Agric Food Chem. 2000;48:5331-5337.
van Elswijk DA, Schobel UP, Lansky EP, Irth H, van der Greef J. Rapid dereplication of estrogen compounds in pomegranate (Punica granatum) using on-line biochemical detection coupled to mass spectrometry. Phytochemistry. 2004;65:233-241.
Noda Y, Kaneyuka T, Mori A, Packer L. Antioxidant activities of pomegranate fruit extract and its anthocyanidins: delphinidin, cyaniding, and pelargonidin. J Agric Food Chem. 2002;50:166-171.
Gil MI, Tomas-Barberan FA, Hess-Pierce B, Holcroft DM, Kader AA. Antioxidant activity of pomegranate juice and its relationship with phenolic composition and processing. J Agric Food Chem. 2000;48:4581-4589.
Manasathien J, Indrapichate K, Intarapichet K. Antioxidant activity and bioefficacy of pomegranate Punica granatum Linn. peel and seed extracts. Global J Pharm. 2012;6(2):131-141.
Manasathien J, Kupittayanant S, Indrapichate K. Protective efficacy of pomegranate (Punica granatum Linn., Punicaceae) peel ethanolic extract on UVB-irradiated rat skin. Am-Eurasian J Toxicol Sci. 2011;3(4):250-258.
Hou DX, Ose T, Lin S, Harazoro K, Imamura I, Kubo M, et al. Anthocyanidins induce apoptosis in human promyelocytic leukemia cells: structure-activity relationship and mechanisms involved. Int J Oncol. 2003;23:705-712.
Adams LS, Seeram NP, Aggarwal BB, Takada Y, Sand D, Heber D. Pomegranate juice, total pomegranate ellagitannins, and punicalagin suppress inflammatory cell signaling in colon cancer cells. J Agric Food Chem. 2006;54:980-985.
Kowalski I, Samojedny A, Paul M, Pietsz G, Wilczok T. Effect of kaemferol on the production and gene expression of monocyte chemoattractant protein-1 in J774.2 macrophages. Pharmacological reports. 2005;PR 57:107-112.
Ackland ML, van de Waarsenburg S, Jone R. Synergistic antiproliferative action of the flavonols quercetin and kaempferol in cultured human cancer cell lines. In Vivo. 2005;19:69-76.
Khan N, Hadi N, Afaq F, Syed DN, Kweon MH, Mukhtar H. Pomegranate fruit extract inhibits prosurvival pathways in human A549 lung carcinoma cells and tumor growth in athymic nude mice. Carcinogenesis. 2007;28:163-173.
Lansky EP, Harrison G, Froom P, Jiang WG. Pomegranate (Punica granatum) pure chemicals show possible synergistic inhibition of human PC-3 prostate cancer cell invasion across Martigel. Invest New Drugs. 2005;23:121-122.
Lansky EP, Jiang W, Mo H, Bravo L, Froom P, Yu W. Possible synergistic prostate cancer suppression by anatomically discrete pomegranate fractions. Invest New Drugs, 2005;23:11-20.
Albrecht M, Jiang W, Kumi-Diaka J, Lansky EP, Gommersall LM, Patel A, et al. Pomegranate extracts potently suppress proliferation, xenograft growth, and invasion of human prostate cancer cells. J Med Food. 2004;7:274-283.
Awad AB, Fink CS. Phytosterols as anticancer dietary components: evidence and mechanism of action. Journal of Nutrition. 2000;130:2127-2133.
Awad AB, Burr AT, Fink CS. Effect of resveratrol and beta-sitosterol in combination on reactive oxygen species and prostaglandin release by PC-3 cells. Prostaglandins Leukot Essent Fatty acids. 2005;72:219-226.
Malik A, Afaq F, Sarfaraz S, Adhami VM, Syed DN, Mukhtar H. Pomegranate fruit juice for chemoprevention and chemotherapy of prostate cancer. Proc Natl Acad Sci USA. 2005;102:14813-14818.
Singleton VL, Orthofer R, Lamuela-Raventos RM. Analysis of total phenols and other oxidation substrates and antioxidations by mean of Folin-Ciocateu reagent. Methods. Enzymol. 1999;299:152-178.
Arnao MB, Cano A, Acusta M. The hydrophilic and lipophilic contribution to total antioxidant activity. Food Chem. 2001;7:239-244.
Re R, Pellegrini N, Proteggente A, Pannala A, Yang M, Rice-Evans C. Antioxidant activity applying an improved ABTS radical action decolorization assay. Free Radic Biol Med. 1999;26:1231-1237.
Mosmann T. Rapid colorimetric for cellular growth and survival: application to proliferation and cytotoxicity assay. J Immunol Methods. 1983;65:55-63.
Manasathien J, Indrapichate K. Apoptosis of MCF-7 cancer cell induced by pomegranate (Punica granatum L.) peel extract. Suranaree J Sci Technol. 2016;21(1):63-74.
Widyawati PS, Budianta TDB, Kusuma FN, Wijaya EL. Differences of solvent polarity to phytochemical content and antioxidant activity of Pluchea indica Less leaves extracts. Int J Pharmacogn Phytochem Res. 2014;6:850-855.
Manasathien J. Effects of mangosteen hull extracts on bioefficacy and antiproliferation of human breast and prostate carcinoma cell lines. Suranaree J Sci Technol. 2017;24(4):475-488.
Chidambara Murthy KN, Jayaprakasha GK, Singh RP. Studies on antioxidant activity of pomegranate (Punica granatum) peel extract using in vivo models. J Agric Food Chem. 2002;50:4791-4795.
Haddad AQ, Venkateswaran V, Viswanathan L, Teahan SJ, Fleshner NE, Klotz LH. Novel antiproliferative flavonoids induce cell cycle arrest in human prostate cancer cell lines. Prostate Cancer Prostatic Dis. 2006;9:68-76.
Henry-Mowatt J, Dive C, Martinou JC, James D. Role of mitochondrial membrane permeabilization in apoptosis and cancer. Oncogene. 2004;23:2850-2560.
Ashkenazi A, Dixit Amundson SA, Myers TG, Scudiero D, Kitada S, Reed JC, Fornace AJ. An informatics approach identifying markers of chemosensitivity in human cancer cell lines. Cancer Res. 2000;60:6101-6110.
Aslam MN, Lansky EP, Varani J. Pomegranate as a cosmeceutical source: Pomegranate fractions promote proliferation and procollagen synthesis and inhibit matrix metalloproteinase-1 production in human skin cells. J Ethnopharmacol. 2006;103:311-318.
Downloads
Published
How to Cite
Issue
Section
License
Copyright (c) 2022 Naresuan Phayao Journal

This work is licensed under a Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License.
ผู้นิพนธ์ต้องรับผิดชอบข้อความในบทนิพนธ์ของตน มหาวิทยาลัยพะเยาไม่จำเป็นต้องเห็นด้วยกับบทความที่ตีพิมพ์เสมอไป ผู้สนใจสามารถคัดลอก และนำไปใช้ได้ แต่จะต้องขออนุมัติเจ้าของ และได้รับการอนุมัติเป็นลายลักษณ์อักษรก่อน พร้อมกับมีการอ้างอิงและกล่าวคำขอบคุณให้ถูกต้องด้วย
The authors are themselves responsible for their contents. Signed articles may not always reflect the opinion of University of Phayao. The articles can be reproduced and reprinted, provided that permission is given by the authors and acknowledgement must be given.







