Effects of elicitors on growth and induction of fructans of jerusalem artichoke (Helianthus tuberosus L.)
Keywords:
Helianthus tuberosus L., Elicitors, Inulin, FructooligosacharidesAbstract
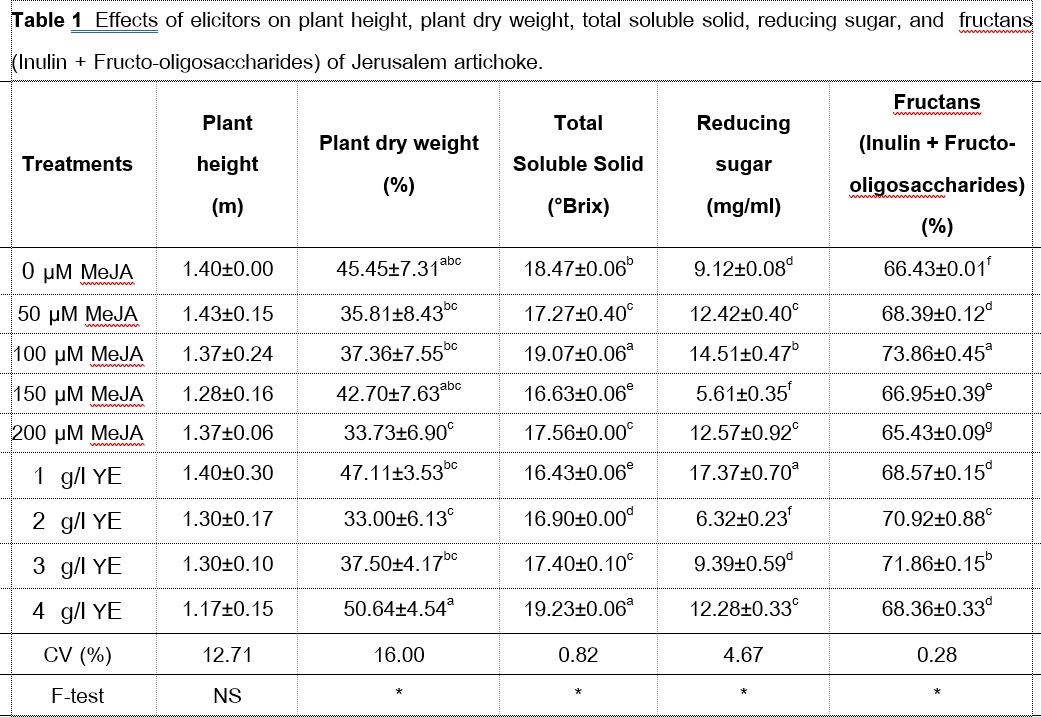
The research aimed to study the effects of two elicitors, methyl jasmonate and yeast extract at different concentrations on growth and Fructans induction of Jerusalem artichoke (Helianthus tuberosus L.) in the field. Randomized complete block design (RCBD) was studied. Each treatment had 3 replications and 10 plants per replication, spraying of each elicitor only one after 30 days of transplantation. The result showed that plant height of all treatments was not statistically significant difference (p>0.05), plant length between 1.17-1.43 m. Jerusalem artichoke were sprayed with control, 150 µM of methyl jasmine and 4 g/l of yeast extract resulted in not statistically significant difference (p>0.05) in the percentage of dry weight of plant. While, Jerusalem artichoke were sprayed with 100 µM of methyl jasmine and 1 g/l of yeast extract resulted the highest amount of total soluble solid which resulted in statistically significant difference (p<0.05) when compared with the control. In this regard, Jerusalem artichoke received 1 g/l of yeast extract gave the highest amount of reducing sugar and 100 µM of Methyl jasmonate gave the highest Fructans (Inulin+Fructo-oligosaccharides) content which resulted in statistically significant difference (p<0.05) when compared with the control.
References
Vorasoot N, Jogloy S. Inulin: Non-digestable cabohydrate as soluable fiber from Kaentawan for human health. Khon Kaen Agric. 2006;34 (2): 85-91.
Orafti. Active food scientific monitor, An Orafti Newsletter, Nr. 12-spring. 2005.
Kolida S, Tuohy K, and Gibson G.R. Prebiotic effects of inulin and oligofructose. British Journal of Nutrition. 2002; 87(2). 193-197.
Singh A, and Dwivedi P. Methyl-jasmonate and salicylic acid as potent elicitors for secondary metabolite production in medicinal plants: A review. Journal of Pharmacognosy and Phytochemistry. 2018;7(1): 750-757.
Putalun W. Plant Tissue Culture: Study Guide for Producing Pharmacologically Active Secondary Substances. Khon Kaen Pimpattana Company Limited, Khon Kaen. 2008;120 p.
Jirapongpattana R, Jirakiattikul Y, Rithichai P. Effects of Jasmonicacid and Yeast Extract on Secondary Metabolite Contents in Shoot Culture of Dioscorea birmanicaPrain & Burkill. Thai Science and Technology Journal. 2017;25(3): 487-496.
Shabani L, Ehsanpour A.A., Asghari G, Emami J. Glycyrrhizin production by in vitro cultured Glycyrrhiza glabra elicited by methyl jasmonate and salicylic acid. Russian Journal of Plant Physiology. 2009;56(5): 621-626.
Chaichana N, Dheeranupattana S. Effects of methyl jasmonate and salicylic acid on alkaloid production from in vitro culture of Stemona sp. International Journal of Bioscience, Biochemistry and Bioinformatics. 2012;2(3): 146-150.
Moharramnejad S, Azam A. T., Panahandeh J, Dehghanian Z, Ashraf M. Effect of methyl jasmonate and salicylic acid on in vitro growth, stevioside production, and oxidative defense system in Stevia rebaudiana. Sugar Tech. 2019;21(6): 1031-1038.
Van Nguyen K, Pongkitwitoon B, Pathomwichaiwat T, Viboonjun U, Prathanturarug S. Effects of methyl jasmonate on the growth and triterpenoid production of diploid and tetraploid Centella asiatica (L.) Urb. hairy root cultures. Scientific reports. 2019;9(1): 1-8.
Marsh Z, Yang T, Nopo-Olazabal L, Wu S, Ingle T, Joshee N, Medina-Bolivar F. Effect of light, methyl jasmonate and cyclodextrin on production of phenolic compounds in hairy root cultures of Scutellaria lateriflora. Phytochemistry. 2014;107: 50-60.
Khitka B. Influence of Methyl Jasmonate on Antioxidant Activity and Nutritional Value of Red Oak Lettuce in Hydroponics Farming System. Khon Kaen Agric. 2014; 42(1): 652-657.
Yodyotee Y. Induced Resistance and Expression of PR-1 Gene in Hevea brasiliensis muell. arg. by Various Stimulants. Degree of Master of Science in Biochemistry. Prince of Songkla University. 2011; 120 p.
Ahmadi F.I., Karimi K, and Struik P.C. Effect of exogenous application of methyl jasmonate on physiological and biochemical characteristics of Brassica napus L. cv. Talaye under salinity stress. South African Journal of Botany. 2018;115: 5-11.
Miller G.L. Use of Dinitrosalicylic Acid Reagent for Determination of Reducing Sugar. Prince of Songkla University Anal. Chem. 1959;31(3), 426–428.
George W. L. Official Methods of Analysis 21th Ed., AOAC INTERNATIONAL, Gaithersburg, MD, Method. 2019.
George W.L. Official Methods of Analysis. 17th Ed., AOAC INTERNATIONAL, Gaithersburg, MD. 2000.
Promchan T, Thanajansri C, Chansanguan P. Effects of Methyl Jasmonate Solution on the Growth Rate of American Marigolds Hybrid. Songklanakarin Journal of Plant Science. 2016; 3(2): 41-48.
Hasanloo T, Khavari-Nejad R.A., Majidi E, Ardakani M.S. Flavonolignan production in cell suspension culture of Silybum marianum, Pharma boil. 2009; 46: 876-882.
Downloads
Published
How to Cite
Issue
Section
License
Copyright (c) 2022 Naresuan Phayao Journal

This work is licensed under a Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License.
ผู้นิพนธ์ต้องรับผิดชอบข้อความในบทนิพนธ์ของตน มหาวิทยาลัยพะเยาไม่จำเป็นต้องเห็นด้วยกับบทความที่ตีพิมพ์เสมอไป ผู้สนใจสามารถคัดลอก และนำไปใช้ได้ แต่จะต้องขออนุมัติเจ้าของ และได้รับการอนุมัติเป็นลายลักษณ์อักษรก่อน พร้อมกับมีการอ้างอิงและกล่าวคำขอบคุณให้ถูกต้องด้วย
The authors are themselves responsible for their contents. Signed articles may not always reflect the opinion of University of Phayao. The articles can be reproduced and reprinted, provided that permission is given by the authors and acknowledgement must be given.







