Establishment and characterization of stable cell-based model expressing Gfp/ SQSTM1/p62 for autophagy modulator screening
Keywords:
Autophagy, Autophagy modulator, Stable cell-based model expressing Gfp/SQSTM1/p62Abstract
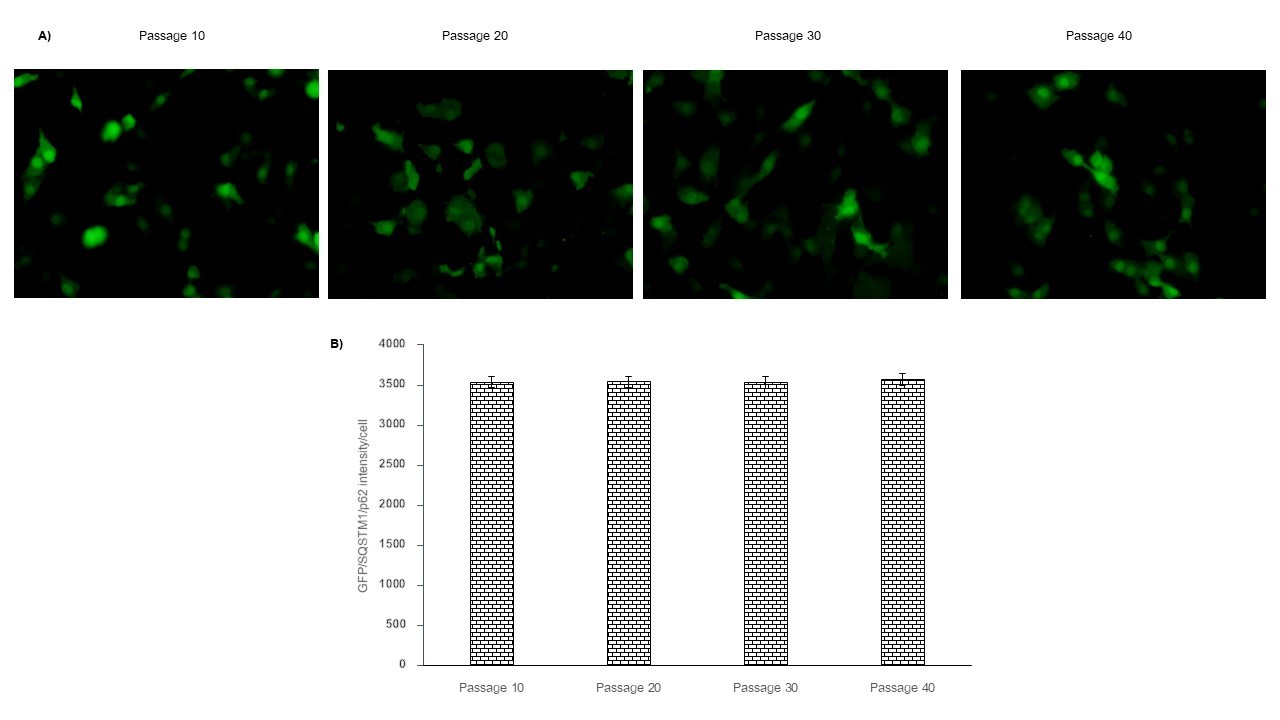
Autophagy plays a key role in a number of diseases, including cancer. This study aimed to generate a stable BHK-21 cell line containing a green fluorescent protein gene (Gfp) and sequestosome 1 gene (SQSTM1/p62) for a cell-based model to screen autophagy modulator. Stable BHK-21 (Gfp/SQSTM1/p62) cell line was established in this study then examined for effectiveness in an autophagy modulator screening assay using rapamycin and chloroquine known autophagy modulators. The SQSTM1/p62 protein turnover has been measured as autophagy activity. The results showed that SQSTM1/p62 protein is active in normal growing conditions at basal level. An induction of autophagy, however, increase the degradation of SQSTM1/p62 protein causes SQSTM1/p62 protein reduction in cells while a decrease or block of this pathway causes SQSTM1/p62 protein accumulation which increases SQSTM1/p62 protein level in cells. This study indicated that stable BHK-21 (Gfp/SQSTM1/p62) cell line is available and efficient for use in an autophagy activity analysis.
References
Levine B, Mizushima N, Virgin HW. Autophagy in immunity and inflammation. Nature 2011; 469: 323-35.
Liu B, Cheng Y, Liu Q, Bao JK, Yang JM. Autophagic pathways as new targets for cancer drug development. Acta Pharmacol Sin. 2010 Sep;31(9):1154-64.
Koukourakis MI, Kalamida D, Giatromanolaki A, Zois CE, Sivridis E, Pouliliou S, et al. Autophagosome proteins LC3A, LC3B and LC3C have distinct subcellular distribution kinetics and expression in cancer cell lines. PLoS One. 2015 Sep; 17;10(9): e0137675 doi: 10.1371.
Ichimura Y, Kirisako T, Takao T, Satomi Y, Shimonishi Y, Ishihara N, et al. A ubiquitin-like system mediates protein lipidation. Nature 2000; 408: 488–92.
Komatsu M, Waguri S, Chiba T, Murata S, Iwata J, Tanida I, et al. Loss of autophagy in the central nervous system causes neurodegeneration in mice. Nature 2006; 441: 880-84.
Kabeya Y, Mizushima N, Ueno T, Yamamoto A, Kirisako T, Noda T, et al. LC3, a mammalian homologue of yeast Apg8p, is localized in autophagosome membranes after processing. EMBO J. 2000; 19(21): 5720-28.
Klionsky DJ, Abdelmohsen K, Abe A, Abedin MJ, Abeliovich H, Arozena JMA, et al. Guidelines for the use and interpretation of assays for monitoring autophagy (3rd edition). Autophagy 2006; 12(1): 1-222.
Sahani MH, Itakura E, Mizushima N. Expression of the autophagy substrate SQSTM1/p62 is restored during prolonged starvation depending on transcriptional upregulation and autophagy-derived amino acids. Autophagy 2014; 10: 431–41.
Bjørkøy G, Lamark T, Brech A, Outzen H, Perander M, Overvatn A, et al. SQSTM1/p62 forms protein aggregates degraded by autophagy and has a protective effect on huntingtin-Induced cell death. J. Cell Biol 2005; 171: 603–14.
He C, Klionsky DJ. Regulation mechanisms and signaling pathways of autophagy. Annu Rev Genet. 2009; 43: 67-93.
Maycotte P, Thorburn A. Autophagy and cancer therapy. Cancer Biol Ther 2011; 11: 127–37.
Janku F, McConkey DJ, Hong DS, Kurzrock R. Autophagy as a target for anticancer therapy. Nat Rev Clin Oncol 2011; 8: 528–39.
Kang R, Zeh HJ, Lotze MT, Tang D. The Beclin 1 network regulates autophagy and apoptosis. Cell Death Differ 2011; 18: 571–80.
Jung CH, Ro SH, Cao J, Otto NM, Kim DH. mTOR regulation of autophagy. FEBS Lett 2010; 584: 1287–95.
Elwira S, Dagmar K. The role of AKT/mTOR pathway in stress response to UV-irradiation: implication in skin carcinogenesis by regulation of apoptosis, Autophagy and Senescence. Int J Mol Sci. 2013 Aug; 14(8): 15260–85.
Homewood CA, Warhurst DC, Peters W, Baggaley VC. Lysosomes, pH and the anti-malarial action of chloroquine. Nature 1972; 235(5332): 50–52.
Leardkamolkarn V, Sirigulpanit W. Establishment of a stable cell line coexpressing dengue virus-2 and green fluorescent protein for screening of antiviral compounds. Journal of Biomolecular Screening 2012; 17(2): 183-93.
Farkas T, Hoyer-Hansen M, Jaattela M. Identification of novel autophagy regulators by a luciferase-based assay for the kinetics of autophagic flux. Autophagy 2009; 5: 1018–25.
Kimura S, Noda T, Yoshimori T. Dissection of the autophagosome maturation process by a novel reporter protein, tandem fluorescent tagged LC3. Autophagy 2007; 3: 452–60.
Beckmann TF, Krämer O, Klausing S, Heinrich C, Thüte T, Büntemeyer H, et al. Effects of high passage cultivation on CHO cells: a global analysis. Appl Microbiol Biot 2012; 94(3): 659–71.
Valente KN, Lenhoff AM, Lee KH. Expression of difficult-to-remove host cell protein impurities during extended Chinese hamster ovary cell culture and their impact on continuous bioprocessing. Biotechnol Bioeng 2015; 112(6): 1232–42.
Ko P. Probing the importance of clonality: single cell subcloning of clonally derived CHO cell lines yields widely diverse clones differing in growth, productivity, and product quality. Biotechnol Prog 2018; 34(3): 624–34.
Davies SL, Lovelady CS, Grainger RK, Racher AJ, Young RJ, James DC. Functional heterogeneity and heritability in CHO cell populations. Biotechnol Bioeng 2013;110(1):260–74.
Grynkiewicz G, Poenie M, Tsien RY. A new generation of Ca2+ indicators with greatly improved fluorescence properties. J Biol Chem. 1985 ; 260: 3440–50.
Zhang AY, Yi F, Teggatz EG, Zou AP. Enhanced production and action of cyclic ADP-ribose during oxidative stress in small bovine coronary arterial smooth muscle. Microvasc Res. 2004; 67: 159–67.
Iwai-Kanai E, Yuan H, Huang C, Sayen MR, Perry-Garza CN, Kim L, et al. A method to measure cardiac autophagic flux in vivo. Autophagy 2008; 4(3): 322-29.
Liu WJ,Luo MN,Tan J, Chen W,Huang LZ, Yang C, et al. Autophagy activation reduces renal tubular injury induced by urinary proteins. Autophagy 2013; 10(2): 243-56 DOI: 10.4161/auto.27004.
Cai Y,Jiajing Cai, Ma Q, Xu Y, Zou J, Xu L, et al. Chloroquine affects autophagy to achieve an anticancer effect in EC109 esophageal carcinoma cells in vitro. Oncol Lett. 2018; 15(1): 1143–48.
Hsu SPC, Kuo JS, Chiang HC, Wang HE, Wang YS, Huang CC, et al. Temozolomide, sirolimus and chloroquine is a new therapeutic combination that synergizes to disrupt lysosomal function and cholesterol homeostasis in GBM cells . Oncotarget. 2018; 9(6): 6883–96.
Cabodevilla AG, Sanchez-Caballero L, Nintou E, Boiadjieva VG, Picatoste F, Gubern A, et al. Cell survival during complete nutrient deprivation depends on lipid droplet-fueled beta-oxidation of fatty acids. J Biol Chem. 2013; 288: 27777–88.
Rambold AS, Cohen S, Lippincott-Schwartz J. Fatty acid trafficking in starved cells: regulation by lipid droplet lipolysis, autophagy, and mitochondrial fusion dynamics. Dev Cell. 2015; 32: 678–92.
Wrighton KH. Lipid metabolism: fatty acids on the move. Nat Rev Mol Cell Biol. 2015; 16: 204.
Rodríguez-Arribas M, Yakhine-Diop SM, Gonzalez-Polo RA, Niso-Santano M, Fuentes JM. Turnover of lipidated LC3 and autophagic cargoes in mammalian cells. Methods Enzymol. 2017;587:55–70.
Tooze SA, Dooley HC, Jefferies HB, Joachim J, Judith D, Lamb CA, et al. Assessing mammalian autophagy. Methods Mol Biol. 2015;1270:155–165.
Tsien RY. The green fluorescent protein. Ann Rev Biochem. 1998;67: 509–44.
Larsen KB, Lamark T, Øvervatn A, Harneshaug I, Johansen T, Bjørkøy G. A reporter cell system to monitor autophagy based on SQSTM1/p62. Autophagy 2010; 6: 784–93. doi: 10.4161/auto.6.6.12510.
Klionsky D, Agholme L, Agnello M, Agostinis P, Aguirre-ghiso JA, Ahn HJ, et al. Guidelines for the use and interpretation of assays for monitoring autophagy. Autophagy 2016; 8: 445–544. doi: 10.4161/auto.19496.
Downloads
Published
How to Cite
Issue
Section
License
Copyright (c) 2021 Naresuan Phayao Journal

This work is licensed under a Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License.
ผู้นิพนธ์ต้องรับผิดชอบข้อความในบทนิพนธ์ของตน มหาวิทยาลัยพะเยาไม่จำเป็นต้องเห็นด้วยกับบทความที่ตีพิมพ์เสมอไป ผู้สนใจสามารถคัดลอก และนำไปใช้ได้ แต่จะต้องขออนุมัติเจ้าของ และได้รับการอนุมัติเป็นลายลักษณ์อักษรก่อน พร้อมกับมีการอ้างอิงและกล่าวคำขอบคุณให้ถูกต้องด้วย
The authors are themselves responsible for their contents. Signed articles may not always reflect the opinion of University of Phayao. The articles can be reproduced and reprinted, provided that permission is given by the authors and acknowledgement must be given.







