Some optimal culture conditions for Marilia sumatrana (Insecta: Trichoptera) larvae in the laboratory
Keywords:
Caddisfly larvae, Rearing, Laboratory, FeedAbstract
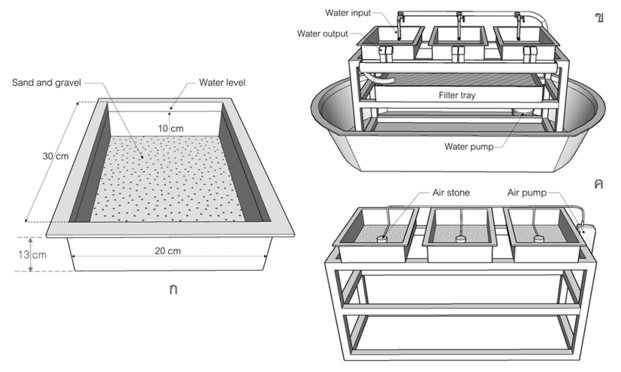
Caddisfly larvae have been used in many fields, such as environmental impact assessment, food preparation, and ornamentals from their cases. However, reported information on the culturing of caddisfly larvae in the laboratory is poorly understood. Therefore, it would be beneficial to study some optimal culture conditions of the Marilia sumatrana larvae in the laboratory. Samples of the larvae (smaller than 5mm) were collected from Yuan Stream, Chiang Kham District, Phayao province. This study was divided into 2 experimental groups (each experimental rearing for 4 weeks). 1) The effects of the flowing and still water rearing systems on the growth and survival rate of M. sumatrana were examined in the laboratory. The results indicated that the survival rates of the flow water treatment were significantly (p < 0.05) higher than that of the still water treatment (91.11 ± 2.12 and 80.00 ± 2.85 %, respectively), whereas the final lengths of larvae cases reared in the flow water and still water were not significantly different (p > 0.05) (13.37 ± 0.73 and 14.07 ± 0.66 mm, respectively). 2) The effect of foods (leaf litter, catfish fry feed and shrimp feed) on the growth and survival rate of M. sumatrana was investigated in the laboratory. The results showed that the final lengths of the larvae cases from treatments fed by catfish fry feed and shrimp feed (12.96 ± 0.42 and 12.74 ± 0.56 mm, respectively) were significantly (p < 0 .05) higher than those fed by leaf litter (8.82 ± 0.25 mm), but the survival rates of any treatment were not significantly different (p > 0.05). In conclusion, the culture conditions of the M. sumatrana larvae in the laboratory should be reared in flowing water and fed with catfish fry feed. Finally, the results of this study might be applied to other types of caddisfly larval culture design.
References
Dudgeon D. Tropical Asian Stream: Zoobenthos, Ecology and Conservation. Hong Kong: Hong Kong University press; 1999. 167 p.
Mackay RJ and Wiggins GB. Ecological diversity in Trichoptera. Annu Rev Entomol. 1979; 24: 185-208.
Holzenthal RW, Blahnik RJ, Prather AL, Kjer KM. Order Trichoptera Kirby 1813 (Insecta), Caddisflies. Zootaxa. 2007; 1668: 639-698.
McCafferty WP. Aquatic Entomology: The Fishermen's and Ecologists' Illustrated Guide to Insects and Their Relatives., 1st ed. Toronto: Jones and Bartlett Publishers Inc; 1981. 448 p.
Césard N, Komatsu S, Iwata A. Processing insect abundance: Trading and fishing of zazamushi in Central Japan (Nagano Prefecture, Honshu Island). J Ethnobiol Ethnomed. 2015; 11(78).DOI: 10.1186/s13002-015-0066-7.
Williams DD, Williams SS. Aquatic insects and their potential to contribute to the diet of the globally expanding human population. Insects, 2017; 8(72). DOI: 10.3390/insects8030072.
Tszydel M, Zabotni A, Wojciechowska D, Michalak M, Krucinska I, Szustakiewicz K, et al. Research on possible medical use of silk produced by caddisfly larvae of Hydropsyche angustipennis (Trichoptera, Insecta). J Mech Behav Biomed Mater. 2015; 45: 142-153.
Kim HJ, Sun Y, Moon MJ. Fine structure of the silk spinning system in the caddisworm, Hydatophylax nigrovittatus (Trichoptera: Limnephilidae). Applied Microscopy. 2020; 50:16. DOI:10.1186/s42649-020-00036-5.
Resh VH, Rosenberg DM. Economic aspects of freshwater invertebrates. In: Thorp JH, Rogers DC, editors. Thorp and covich’s freshwater invertebrates: Ecology and general biology. San Diego: Elsevier; 2015. p. 98-109.
Mann D, Prompiya S, Pinmongkholgul S, Seetapan K. Diversity of Trichoptera larvae in Ngim and Yuan Stream, Phayao Province and its utilization. Proceeding of the 10th Thai Forest Ecological Research Network Conference; 2021 feb 4-5; Maejo university Phrea campus, Phrea.
Hoffman AL, Olden JD, Monroe JB, Poff NL, Wellnitz T, Wiens JA. Current velocity and habitat patchiness shape stream herbivore movement. Oikos. 2006; 115: 358-368.
Verdonschot PFM, Lototskaya AAB, Dekkers DBM, Verdonschot, RCM. Mobility of lowland stream Trichoptera under experimental habitat and flow conditions. Limnologica. 2012; 42: 227-234.
Okano J, Kikuchi E. Effect of current velocity and case adaptations on the distribution of caddisfly larvae (Glossosoma, Trichoptera). Limnology. 2012; 13: 37-43.
Genkai-Kato M, Nozaki K, Mitsuhashi H, Kohmatsu Y, Miyasaka H, Nakamura M, Push-up response of stonefly larvae in low-oxygen conditions. Ecol Res. 2000; 15: 175–179.
Seetapan K, Klahan R, Pimpang R, Phuchai W. Practical diet for rearing caddis worm in family Odontoceridae. J Fish Tech Res. 2010; 4(1): 111-115.
Ghaly AE, Alkoaik FN. Extraction of protein from common plant leaves for use as human food. Am J Appl Sci. 2010; 7 (3): 331-342.
Arias-Real R, Menéndez M, Abril M, Oliva F, Muñoz. Quality and quantity of leaf litter: Both are important for feeding preferences and growth of an aquatic shredder. PLoS ONE. 2018; 13(12): e0208272. http://doi.org/10.1371/journal.pone.0208272.
Wiggins GB. Larvae of The North American Caddisfly Genera (Trichoptera), 2nd ed. Toronto: The University of Toronto press; 1996. 457 p.
Downloads
Published
How to Cite
Issue
Section
License
Copyright (c) 2023 Naresuan Phayao Journal

This work is licensed under a Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License.
ผู้นิพนธ์ต้องรับผิดชอบข้อความในบทนิพนธ์ของตน มหาวิทยาลัยพะเยาไม่จำเป็นต้องเห็นด้วยกับบทความที่ตีพิมพ์เสมอไป ผู้สนใจสามารถคัดลอก และนำไปใช้ได้ แต่จะต้องขออนุมัติเจ้าของ และได้รับการอนุมัติเป็นลายลักษณ์อักษรก่อน พร้อมกับมีการอ้างอิงและกล่าวคำขอบคุณให้ถูกต้องด้วย
The authors are themselves responsible for their contents. Signed articles may not always reflect the opinion of University of Phayao. The articles can be reproduced and reprinted, provided that permission is given by the authors and acknowledgement must be given.







