สารสกัดดอกบัวหลวงลดพิษของไฮโดรเจนเปอร์ออกไซด์ในเซลล์ไฟโบรบลาสต์ผิวหนัง
คำสำคัญ:
ดอกบัวหลวง, เซลล์ไฟโบรบลาสต์, ไฮโดรเจนเปอร์ออกไซด์, โพลิฟีนอล, สารต้านอนุมูลอิสระบทคัดย่อ
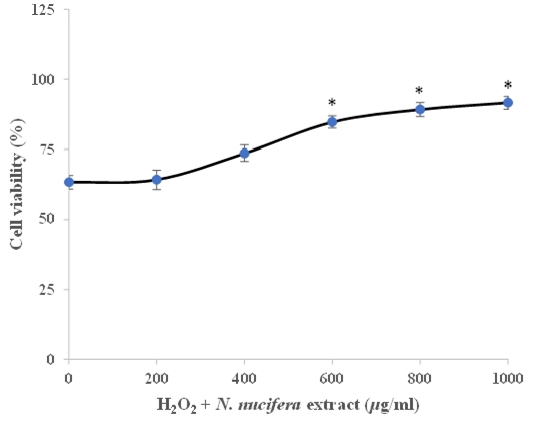
เซลล์ไฟโบรบลาสต์มีบทบาทสำคัญในการรักษาภาวะธำรงดุลของผิวหนัง ภาวะเครียดออกซิเดชันอันเกิดจากสารอนุมูลอิสระออกซิเจนพบว่าก่ออันตรายให้กับเซลล์ชนิดนี้ ส่งผลให้เกิดการชราและการตายของเซลล์ก่อนเวลาอันควร งานวิจัยนี้จึงมีจุดประสงค์เพื่อประเมินความสามารถในการป้องกันเซลล์ไฟโบรบลาสต์จากการทำลายด้วยสารไฮโดรเจนเปอร์ออกไซด์ (จำลองการตายของเซลล์อันเนื่องมาจากภาวะเครียดออกซิเดชัน) การศึกษาบ่งชี้ว่าเซลล์ ไฟโบรบลาสต์ที่บ่มร่วมกับสารสกัดดอกบัวหลวง ความเข้มข้น 0-1,000 ไมโครกรัมต่อมิลลิลิตร มีแนวโน้มเพิ่มอัตราการรอดชีวิตของเซลล์ได้เมื่อได้รับสารไฮโดรเจนเปอร์ออกไซด์ที่ความเข้มข้น 400 ไมโครกรัมต่อมิลลิลิตร และเมื่อบ่มเซลล์กับสารสกัดดอกบัวหลวงความเข้มข้น 400-1,000 ไมโครกรัมต่อมิลลิลิตร เป็นเวลา 48 ชั่วโมง อัตราการรอดชีวิตจะเพิ่มอย่างมีนัยสำคัญ (p < 0.05) เมื่อเทียบกับกลุ่มควบคุม ทั้งนี้ความสามารถในการป้องกันเซลล์จากพิษของสารไฮโดรเจนเปอร์ออกไซด์ อาจเนื่องมาจากการที่สารสกัดดอกบัวหลวงมีองค์ประกอบที่น่าสนใจ กล่าวคือ มีสารฟลาโวนอยด์ 23.69±1.94 มิลลิกรัมสมมูลเควอเซตินต่อกรัม และสารโพลิฟีนอล 39.26±1.56 มิลลิกรัมสมมูลกรดกัลลิกต่อกรัม อีกทั้งสารสกัดดอกบัวหลวงยังมีฤทธิ์ต้านอนุมูลอิสระในหลอดทดลอง ซึ่งสัมพันธ์กับองค์ประกอบทางเคมีที่กล่าวข้างต้น และเป็นคุณสมบัติสำคัญที่ช่วยป้องกันเซลล์ไฟโบรบลาสต์ไม่ให้เกิดการตายเมื่อสัมผัสกับสารไฮโดรเจนเปอร์ออกไซด์ ดังนั้น การศึกษาเพื่อประเมินศักยภาพในการป้องกันการทำลายและกระบวนการชราของเซลล์ชนิดนี้ จะช่วยเพิ่มข้อมูลพื้นฐานทางชีวเคมีของสารพฤกษเคมีและเกิดประโยชน์ต่อการส่งเสริมสุขภาพเซลล์ผิว
เอกสารอ้างอิง
Herb M, Gluschko A, Schramm M. Reactive Oxygen Species: Not Omnipresent but Important in Many Locations. Front Cell Dev Biol. 2021;9:716406.
Brun C, Jean-Louis F, Oddos T, Bagot M, Bensussan A, Michel L. Phenotypic and functional changes in dermal primary fibroblasts isolated from intrinsically aged human skin. Exp Dermatol. 2016;25(2):113-9.
Chen JH, Ozanne SE, Hales CN. Methods of cellular senescence induction using oxidative stress. Methods Mol Biol. 2007;371:179-89.
Bladier C, Wolvetang EJ, Hutchinson P, de Haan JB, Kola I. Response of a primary human fibroblast cell line to H2O2: senescence-like growth arrest or apoptosis? Cell Growth Differ. 1997;8(5):589-98.
Agati G, Azzarello E, Pollastri S, Tattini M. Flavonoids as antioxidants in plants: location and functional significance. Plant Sci. 2012;196:67-76.
Domaszewska-Szostek A, Puzianowska-Kuznicka M, Kurylowicz A. Flavonoids in Skin Senescence Prevention and Treatment. Int J Mol Sci. 2021;22(13).
Yang RZ, Wei XL, Gao FF, Wang LS, Zhang HJ, Xu YJ, et al. Simultaneous analysis of anthocyanins and flavonols in petals of lotus (Nelumbo) cultivars by high-performance liquid chromatography-photodiode array detection/electrospray ionization mass spectrometry. J Chromatogr A. 2009;1216(1): 106-12.
Kim T, Kim HJ, Cho SK, Baek H, Jeon HY, Kim B, et al. Nelumbo nucifera extracts as whitening and anti-wrinkle cosmetic agent. Korean J Chem Engineer. 2011;28:424-27.
Chen G, Zhu M, Guo M. Research advances in traditional and modern use of Nelumbo nucifera: phytochemicals, health promoting activities and beyond. Crit Rev Food Sci Nutr. 2019;59(sup1):S189-S209.
Limwachiranon J, Huang H, Shi Z, Li L, Luo Z. Lotus Flavonoids and Phenolic Acids: Health Promotion and Safe Consumption Dosages. Compr Rev Food Sci Food Saf. 2018;17(2):458-71.
Temviriyanukul P, Sritalahareuthai V, Promyos N, Thangsiri S, Pruesapan K, Srinuanchai W, et al. The Effect of Sacred Lotus (Nelumbo nucifera) and Its Mixtures on Phenolic Profiles, Antioxidant Activities, and Inhibitions of the Key Enzymes Relevant to Alzheimer's Disease. Molecules. 2020;25(16).
La-Ongsri W, Trisonthi C, Balslev H. Management and use of Nelumbo nucifera Gaertn. in Thai wetlands. Wetl Ecol Manag. 2008;17:279-89.
Phimnuan P, Rukchay R, Tiraravesit NW, S.Chaturnratsamee, S., Pittayanurak P, Reutrakul V, Viyoch J. Protective effects of lotus stamen extract on UV-B-irradiated skin cells activities. Songklanakarin J Sci Technol. 2020;42(2):383-90.
Ainsworth EA, Gillespie KM. Estimation of total phenolic content and other oxidation substrates in plant tissues using Folin-Ciocalteu reagent. Nat Protoc. 2007;2(4):875-7.
da Silva LA, Pezzini BR, Soares L. Spectrophotometric determination of the total flavonoid content in Ocimum basilicum L. (Lamiaceae) leaves. Pharmacogn Mag. 2015;11(41):96-101.
Kedare SB, Singh RP. Genesis and development of DPPH method of antioxidant assay. J Food Sci Technol. 2011;48(4):412-22.
Benzie IF, Strain JJ. The ferric reducing ability of plasma (FRAP) as a measure of "antioxidant power": the FRAP assay. Anal Biochem. 1996;239(1):70-6.
Wang Z, Wei D, Xiao H. Methods of cellular senescence induction using oxidative stress. Methods Mol Biol. 2013;1048:135-44.
Charoensin S. Antioxidant and anticancer activities of Moringa oleifera leaves. J Med Plant Res. 2014;527:3-19.
Marinho HS, Cyrne L, Cadenas E, Antunes F. The cellular steady-state of H2O2: latency concepts and gradients. Methods Enzymol. 2013;527:3-19.
Kunanusorn P, Panthong A, Pittayanurak P, Wanauppathamkul S, Nathasaen N, Reutrakul V. Acute and subchronic oral toxicity studies of Nelumbo nucifera stamens extract in rats. J Ethnopharmacol. 2011;134(3):789-95.
Park WH. H2O2 inhibits the growth of human pulmonary fibroblast cells by inducing cell death, GSH depletion and G1 phase arrest. Mol Med Rep. 2013;7(4):1235-40.
Cox AG, Winterbourn CC, Hampton MB. Mitochondrial peroxiredoxin involvement in antioxidant defence and redox signalling. Biochem J. 2009;425(2):313-25.
Rhee SG, Kil IS. Mitochondrial H2O2 signaling is controlled by the concerted action of peroxiredoxin III and sulfiredoxin: Linking mitochondrial function to circadian rhythm. Free Radic Biol Med. 2016;100:73-80.
Lagoa R, Graziani I, Lopez-Sanchez C, Garcia-Martinez V, Gutierrez-Merino C. Complex I and cytochrome c are molecular targets of flavonoids that inhibit hydrogen peroxide production by mitochondria. Biochim Biophys Acta. 2011;1807(12):1562-72.
ดาวน์โหลด
เผยแพร่แล้ว
รูปแบบการอ้างอิง
ฉบับ
ประเภทบทความ
สัญญาอนุญาต
ลิขสิทธิ์ (c) 2023 วารสารนเรศวรพะเยา

อนุญาตภายใต้เงื่อนไข Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License.
ผู้นิพนธ์ต้องรับผิดชอบข้อความในบทนิพนธ์ของตน มหาวิทยาลัยพะเยา ไม่จำเป็นต้องเห็นด้วยกับบทความที่ตีพิมพ์เสมอไป ผู้สนใจสามารถคัดลอก และนำไปใช้ได้ แต่จะต้องขออนุมัติเจ้าของ และได้รับการอนุมัติเป็นลายลักษณ์อักษรก่อน พร้อมกับมีการอ้างอิงและกล่าวคำขอบคุณให้ถูกต้องด้วย







