ฤทธิ์ยับยั้งเซลล์มะเร็งลำไส้ใหญ่ชนิด HT29 จากสารสกัดไผ่จืด
คำสำคัญ:
โรคมะเร็งลำไส้ใหญ่และทวารหนัก, ฤทธิ์ต้านมะเร็ง, สารสกัดไผ่จืดบทคัดย่อ
โรคมะเร็งลำไส้ใหญ่เป็นมะเร็งที่พบมากที่สุดเป็นอันดับ 3 ของมะเร็งทั่วโลก พบมากในผู้ที่มีอายุ 50 ปีขึ้นไป แม้ว่าปัจจัยด้านสิ่งแวดล้อมและพันธุกรรมมีบทบาทสำคัญในการก่อโรค แต่งานวิจัยจำนวนมากแสดงให้เห็นบทบาทของโภชนาการเกี่ยวกับสาเหตุและการป้องกันมะเร็งลำไส้ใหญ่ ไผ่จืด Pogonatherum paniceum (Lam.) Hack เป็นพืชตระกูลหญ้ามีฤทธิ์โดดเด่นในการขับสารพิษออกจากร่างกาย งานวิจัยนี้สนใจศึกษาฤทธิ์ต้านมะเร็งของสารสกัดไผ่จืดรวมไปถึงกลไกที่เกี่ยวข้อง ทดสอบฤทธิ์ต้านการเจริญของเซลล์มะเร็งลำไส้ใหญ่ ชนิด Human Colorectal HT29 Cells ด้วยวิธี MTT assay, MTS assay และ colony formation assay จากนั้นศึกษากลไกการยับยั้งเซลล์มะเร็ง ได้แก่
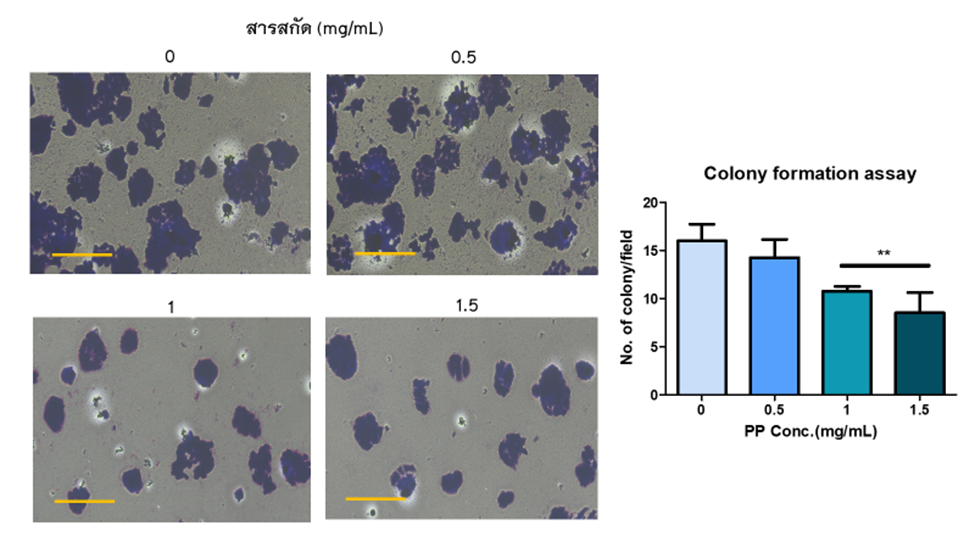
การกระตุ้นการตายของเซลล์ ด้วยวิธี ELISA ซึ่งตรวจวัดปริมาณ histone-associated DNA fragments จากการทดสอบแสดงให้เห็นว่า สารสกัดไผ่จืดทำให้อัตราการรอดชีวิตของเซลล์มะเร็ง HT29 ลดลง 50% ที่เวลา 48 ชั่วโมง
โดยแสดงให้เห็นจากค่า IC50 เท่ากับ 1.2 ± 0.06 mg/ml และที่ความเข้มข้น 0.5 และ 0.75 mg/ml สารสกัดไผ่จืดสามารถทำให้เกิดการกระตุ้นการตายของเซลล์มะเร็งแบบอะพอพโตซิสได้ จึงสามารถสรุปได้ว่าสารสกัดไผ่จืดมีฤทธิ์ยับยั้งการเพิ่มจำนวนของเซลล์มะเร็งลำไส้ใหญ่ โดยกระตุ้นให้เกิดการตายแบบอะพอพโตซิส
เอกสารอ้างอิง
Chueh AC, Tse JWT, Tögel L, Mariadason JM. Mechanisms of Histone Deacetylase Inhibitor-Regulated Gene Expression in Cancer Cells. Antioxid Redox Signal. 2015 Jul 1;23(1):66–84.
Rs W. Apoptosis in cancer: from pathogenesis to treatment. J Exp Clin Cancer Res CR [Internet]. 2011 Sep 26 [cited 2023 Mar 29];30(1). Available from: https://pubmed.ncbi.nlm.nih.gov/21943236/
Pavlova NN, Zhu J, Thompson CB. The hallmarks of cancer metabolism: Still emerging. Cell Metab. 2022 Mar 1;34(3):355–77.
Angwa LM, Jiang Y, Pei J, Sun D. Antioxidant Phytochemicals for the Prevention of Fluoride-Induced Oxidative Stress and Apoptosis: a Review. Biol Trace Elem Res. 2022 Mar;200(3):1418–41.
Muniyandi K, George E, Sathyanarayanan S, George BP, Abrahamse H, Thamburaj S, et al. Phenolics, tannins, flavonoids and anthocyanins contents influenced antioxidant and anticancer activities of Rubus fruits from Western Ghats, India. Food Sci Hum Wellness. 2019 Mar;8(1):73–81.
Junsongduang A, Nabundit O, Chinnawong P, Tanming W, Balslev H. Medicinal Plants Used by Tai Lao Healers in Roi Et Thailand. 2021.
Ai T, Liao X, Li R, Fan L, Luo F, Xu Y, et al. GDP-D-mannose pyrophosphorylase from Pogonatherum paniceum enhances salinity and drought tolerance of transgenic tobacco. Z Naturforschung C J Biosci. 2016;71(7–8):243–52.
Kumar P, Nagarajan A, Uchil PD. Analysis of Cell Viability by the MTT Assay. Cold Spring Harb Protoc. 2018 Jun 1;2018(6).
Wang Y, Nguyen DT, Yang G, Anesi J, Kelly J, Chai Z, et al. A Modified MTS Proliferation Assay for Suspended Cells to Avoid the Interference by Hydralazine and β-Mercaptoethanol. Assay Drug Dev Technol. 2021 Apr;19(3):184–90.
Ratsada P, Hijiya N, Hidano S, Tsukamoto Y, Nakada C, Uchida T, et al. DUSP4 is involved in the enhanced proliferation and survival of DUSP4-overexpressing cancer cells. Biochem Biophys Res Commun. 2020 Jul 30;528(3):586–93.
Praphasawat R, Thakaew S, Rawangkan A, Thongboontho R, Sooksaen P, Laovittayangkoon S, et al. Anticancer and Antimutagenic Properties of Pogonatherum paniceum on Colorectal Cancer Cells. World J Oncol. 2023 Aug;14(4):266–76.
Bona NP, Pedra NS, Azambuja JH, Soares MSP, Spohr L, Gelsleichter NE, et al. Tannic acid elicits selective antitumoral activity in vitro and inhibits cancer cell growth in a preclinical model of glioblastoma multiforme. Metab Brain Dis. 2020 Feb;35(2):283–93.
Chen KS, Hsiao YC, Kuo DY, Chou MC, Chu SC, Hsieh YS, et al. Tannic acid-induced apoptosis and -enhanced sensitivity to arsenic trioxide in human leukemia HL-60 cells. Leuk Res. 2009 Feb;33(2):297–307.
Darvin P, Baeg SJ, Joung YH, Sp N, Kang DY, Byun HJ, et al. Tannic acid inhibits the Jak2/STAT3 pathway and induces G1/S arrest and mitochondrial apoptosis in YD-38 gingival cancer cells. Int J Oncol. 2015 Sep;47(3):1111–20.
Yoshioka K, Kataoka T, Hayashi T, Hasegawa M, Ishi Y, Hibasami H. Induction of apoptosis by gallic acid in human stomach cancer KATO III and colon adenocarcinoma COLO 205 cell lines. Oncol Rep. 2000;7(6):1221–3.
The anthocyanin metabolites gallic acid, 3-O-methylgallic acid, and 2,4,6-trihydroxybenzaldehyde decrease human colon cancer cell viability by regulating pro-oncogenic signals - PubMed [Internet]. [cited 2023 Mar 31]. Available from: https://pubmed.ncbi.nlm.nih.gov/23124926/
Subramanian AP, Jaganathan SK, Mandal M, Supriyanto E, Muhamad II. Gallic acid induced apoptotic events in HCT-15 colon cancer cells. World J Gastroenterol. 2016 Apr 21;22(15):3952–61.
Yuan JM, Sun C, Butler LM. Tea and cancer prevention: epidemiological studies. Pharmacol Res. 2011 Aug;64(2):123–35.
ดาวน์โหลด
เผยแพร่แล้ว
รูปแบบการอ้างอิง
ฉบับ
ประเภทบทความ
สัญญาอนุญาต
ลิขสิทธิ์ (c) 2023 มหาวิทยาลัยพะเยา

อนุญาตภายใต้เงื่อนไข Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License.
ผู้นิพนธ์ต้องรับผิดชอบข้อความในบทนิพนธ์ของตน มหาวิทยาลัยพะเยา ไม่จำเป็นต้องเห็นด้วยกับบทความที่ตีพิมพ์เสมอไป ผู้สนใจสามารถคัดลอก และนำไปใช้ได้ แต่จะต้องขออนุมัติเจ้าของ และได้รับการอนุมัติเป็นลายลักษณ์อักษรก่อน พร้อมกับมีการอ้างอิงและกล่าวคำขอบคุณให้ถูกต้องด้วย







