การประเมินสภาวะที่เหมาะสมต่อการทำงานของเอนไซม์โบรมีเลนจากสับปะรดภูเก็ต
Main Article Content
บทคัดย่อ
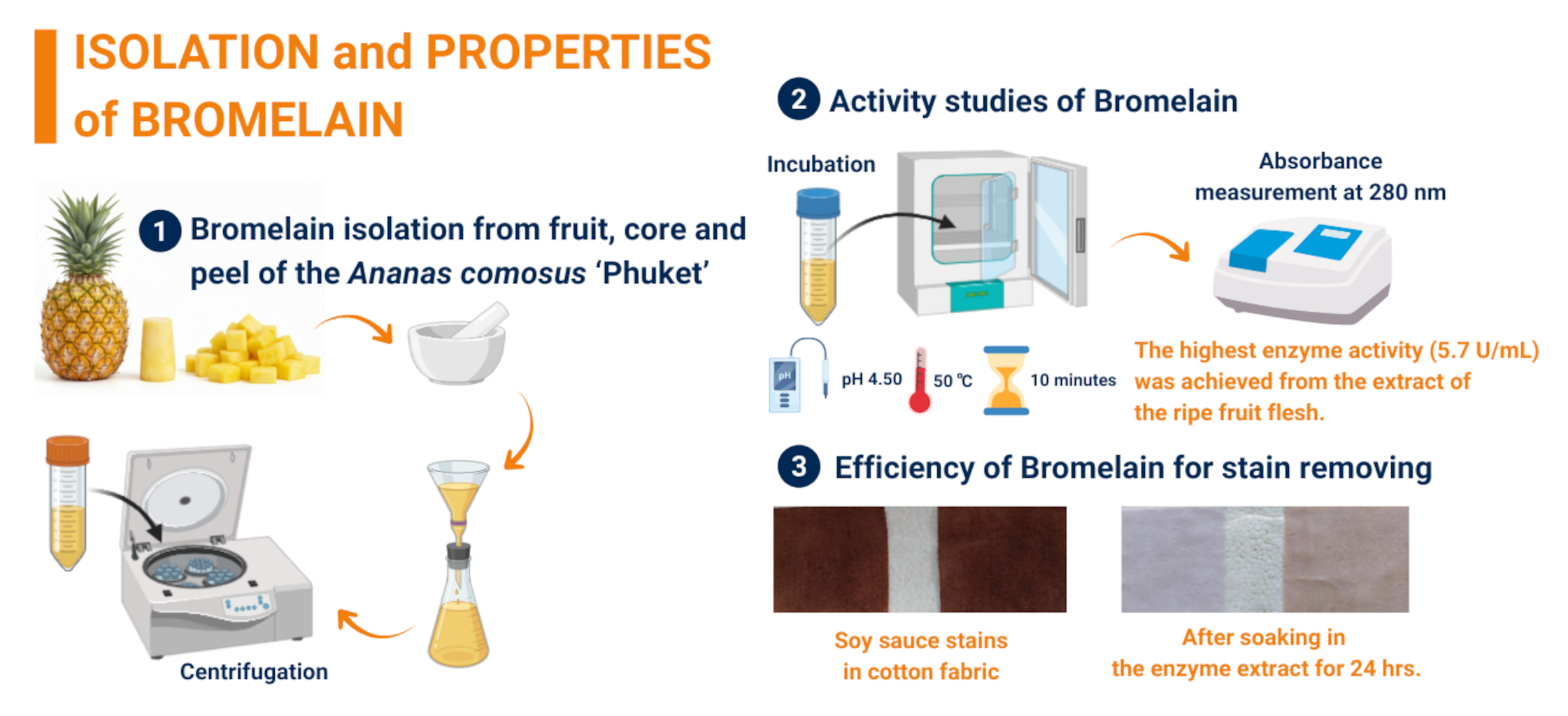
โบรมีเลนเป็นชื่อทั่วไปของเอนไซม์โปรตีโอไลติกที่มีหมู่ซัลฟ์ไฮดริลที่บริเวณเร่ง ซึ่งได้จากสับปะรด (Ananas comosus (L.) Merr.) ทำหน้าที่ในการย่อยสลายโปรตีน งานวิจัยนี้มีวัตถุประสงค์เพื่อเปรียบเทียบกิจกรรมเอนไซม์โบรมีเลนสกัดหยาบจากส่วนเนื้อ แกน และเปลือกของสับปะรดภูเก็ต (A. comosus (L.) Merr. cv. Phuket) รวมถึงศึกษาความแตกต่างระหว่างสับปะรดภูเก็ตผลดิบและผลสุก ทำการหากิจกรรมเอนไซม์โบรมีเลนสกัดหยาบโดยวัดปริมาณไทโรซีนที่แสดงออกมาเปรียบเทียบกับไทโรซีนมาตรฐานและแสดงผลในหน่วยยูนิตต่อมิลลิลิตรของเอนไซม์ ผลการทดลองพบว่ากิจกรรมเอนไซม์สูงสุดได้จากส่วนเนื้อของสับปะรดภูเก็ตผลสุก โดยแสดงค่ากิจกรรมสูงสุดภายใต้สภาวะค่าความเป็นกรด-ด่างเท่ากับ 4.5 บ่มที่อุณหภูมิ 50 องศาเซลเซียส และใช้ระยะเวลา 10 นาที เมื่อใช้เคซีนเป็นสารตั้งต้น ซึ่งให้ค่ากิจกรรมเอนไซม์เป็น 5.4 และ 5.7 ยูนิตต่อมิลลิลิตร ตามลำดับ นอกจากนี้ยังได้ประเมินประสิทธิภาพของสารสกัดเอนไซม์ที่ค่าความเป็นกรด-ด่างเท่ากับ 4.5 และบ่มที่อุณหภูมิ 50 องศาเซลเซียส ในการขจัดคราบซีอิ๊วบนผ้าฝ้าย พบว่าเอนไซม์โบรมีเลนสกัดหยาบสามารถขจัดคราบได้อย่างมีประสิทธิภาพสูงสุดเมื่อแช่ผ้าในสารสกัดเป็นเวลา 24 ชั่วโมง ผลการศึกษานี้ชี้ให้เห็นว่าเอนไซม์โบรมีเลนจากส่วนเนื้อของสับปะรดภูเก็ตมีศักยภาพสูงสำหรับการประยุกต์ใช้ในอุตสาหกรรมซักฟอก และอาจนำไปพัฒนาต่อยอดเป็นผลิตภัณฑ์เอนไซม์สำหรับการดูแลสิ่งทอในอนาคต
Article Details

อนุญาตภายใต้เงื่อนไข Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License.
เนื้อหาและข้อมูลในบทความที่ลงตีพิมพ์ในวารสารวิชชา มหาวิทยาลัยราชภัฏนครศรีธรรมราช ถือเป็นข้อคิดเห็นและความรับผิดชอบของผู้เขียนบทความโดยตรง ซึ่งกองบรรณาธิการวารสารไม่จำเป็นต้องเห็นด้วยหรือร่วมรับผิดชอบใด ๆ
บทความ ข้อมูล เนื้อหา รูปภาพ ฯลฯ ที่ได้รับการตีพิมพ์ในวารสารวิชชา มหาวิทยาลัยราชภัฏนครศรีธรรมราช ถือเป็นลิขสิทธ์ของวารสารวิชชา มหาวิทยาลัยราชภัฏนครศรีธรรมราช หากบุคคลหรือหน่วยงานใดต้องการนำข้อมูลทั้งหมดหรือส่วนหนึ่งส่วนใดไปเผยแพร่ต่อหรือเพื่อการกระทำการใด ๆ จะต้องได้รับอนุญาตเป็นลายลักษณ์อักษรจากวารสารวิชชา มหาวิทยาลัยราชภัฏนครศรีธรรมราชก่อนเท่านั้น
The content and information in the article published in Wichcha journal Nakhon Si Thammarat Rajabhat University, It is the opinion and responsibility of the author of the article. The editorial journals do not need to agree. Or share any responsibility.
เอกสารอ้างอิง
จารุพันธ์ ทองแถม. (2526). สับปะรดและอุตสาหกรรมสับปะรดในประเทศไทย. กรุงเทพฯ: ภาควิชาพืชสวน คณะเกษตร มหาวิทยาลัยเกษตรศาสตร์.
ภาวิณีย์ เจริญยิ่ง. (2559). สับปะรดภูเก็ต. สืบค้นเมื่อ 5 พฤษภาคม 2566, จาก: https://www.khaosod.co.th/technologychaoban/techno/plants-vegetables-fruit/article_6226.
มนตรี กล้าขาย. (2559). เกษตรหลังเกษียณ ปลูกสับปะรดในถุงพลาสติกพลิกวิกฤตให้เป็นโอกาส. เทคโนโลยีชาวบ้าน, 28(625), 41-42.
อาภัสสร ศิริจริยวัตร และกาญจนาพร นนทะลุน. (2563). กิจกรรมการย่อยโปรตีนของสารสกัดหยาบจากส่วนต่าง ๆ ของสับปะรดและมะละกอ. แก่นเกษตร, 28(พิเศษ 1), 1887-1092.
Arshad, Z.I.M., Amid, A., Yusof, F., Jaswir, I., Ahmad, K. and Loke, S.P. (2014). Bromelain: An overview of industrial application and purification strategies. Applied Microbiology and Biotechnology, 98(17), 7283-7297, doi: https://doi.org/10.1007/s00253-014-5889-y.
Babu, B.R., Rastogi, N.K. and Raghavarao, K.S.M.S. (2008). Liquid-liquid extraction of bromelain and polyphenol oxidase using aqueous two-phase system. Chemical Engineering and Processing, 47(1), 83-89, doi: https://doi.org/10.1016/j.cep.2007.08.006.
Bhagavathy, S., Gayathridevi, R., Pushya, K. and Jeniffer, J. (2019). Screening, optimization and antimicrobial activity of bromelain from Ananas comosus. International Journal of Scientific Development and Research, 4(8), 233-240.
Bonner, P.L.R. (2007). Protein purification. London: Taylor and Francis Group.
Dubey, R., Reddy, S. and Murthy, N.Y.S. (2012). Optimization of activity of bromelain. Asian Journal of Chemistry, 24(4), 1429-1431.
Gu, Y. (2024). The effect of buffer pH on enzyme activity. Theoretical and Natural Science, 33, 137-147, doi: https://doi.org/10.54254/2753-8818/33/20240893.
Harrach, T., Eckert, K., Schulze-Forster, K., Nuck, R., Grunow, D. and Maurer, H.R. (1995). Isolation and partial characterization of basic proteinases from stem bromelain. Journal of Protein Chemistry, 14(1), 41-52, doi: https://doi.org/10.1007/BF01902843.
Hebbar, H.U., Hemavathi, A.B., Sumana, B. and Raghavarao K.S.M.S. (2011). Reverse micellar extraction of bromelain from pineapple (Ananas comosus L. merryl) waste: Scale-up, reverse micelles characterization and mass transfer studies. Separation Science and Technology, 46(10), 1656-1664, doi: https://doi.org/10.1080/01496395.2011.572110.
Hossain, M.M., Lee, S.I. and Kim, I.H. (2015). Effects of bromelain supplementation on growth performance, nutrient digestibility, blood profiles, faecal microbial shedding, faecal score and faecal noxious gas emission in weanling pigs. Veterinarni Medicina, 60(10), 544-552, doi: https://doi.org/10.17221/8493-VETMED.
Jutamongkon, R. and Charoenrein, S. (2010). Effect of temperature on the stability of fruit bromelain from smooth cayenne pineapple. Agriculture and Natural Resources, 44(5), 943-948.
Kavitha, S., Kumar, S.A., Yogalakshmi, K.N., Kaliappan, S. and Banu, J.R. (2013). Effect of enzyme secreting bacterial pretreatment on enhancement of aerobic digestion potential of waste activated sludge interceded through EDTA. Bioresource Technology, 150, 210-219, doi: https://doi.org/10.1016/j.biortech.2013.10.021.
Ketnawa, S., Chaiwut, P. and Rawdkuen, S. (2011). Aqueous two-phase extraction of bromelain from pineapple peels (‘Phu Lae’ cultv.) and its biochemical properties. Food Science and Biotechnology, 20(5), 1219-1226, doi: https://doi.org/10.1007/s10068-011-0168-5.
Ketnawa, S., Chiwut, P. and Rawduken, S. (2012). Pineapple wastes: A potential source for bromelain extraction. Food and Bioproducts Processing, 90(3), 385-391, doi: https://doi.org/10.1016/j.fbp.2011.12.006.
Koh, J., Kang, S.-M., Kim, S.-J., Cha, M.-K. and Kwon, Y.-J. (2006). Effect of pineapple protease on the characteristics of protein fibers. Fibers and Polymers, 7(2), 180-185, doi: https://doi.org/10.1007/BF02908264.
Martins, B.C., Rescolino, R., Coelho, D.F., Zanchetta, B., Tambourgi, E.B. and Silveira, E. (2014). Characterization of bromelain from Ananas comosus agroindustrial residues purified by ethanol fractional precipitation. Chemical Engineering Transactions, 37, 781-786, doi: https://doi.org/10.3303/CET1437131.
Mohan, R., Sivakumar, V., Rangasamy, T. and Muralidharan, C. (2016). Optimisation of bromelain enzyme extraction from pineapple (Ananas comosus) and application in process industry. American Journal of Biochemistry and Biotechnology, 12(3), 188-195, doi: https://doi.org/10.3844/ajbbsp.2016.188.195.
Mohapatra, A., Rao, V.M. and Ranjan, M. (2013). Comparative study of the increased production and characterization of bromelain from the peel, pulp and stem pineapple (Anannus commas). International Journal of Advanced Research and Technology, 2, 249-279.
More, K., Popalghat, S., Yadav, S. and Namekar, T. (2019). Extraction and partial purification of bromelain from fruit and crown of pineapple (Ananas comosus) and it’s application as a meat tenderizer. International Journal of Pharmacy and Biological Sciences, 9(3), 1361-1367.
Murachi, T. and Neuratii, H. (1960). Fractionation and specificity studies on stem bromelain. Journal of Biological Chemistry, 235(1), 99-107, doi: https://doi.org/10.1016/S0021-9258(18)69593-6.
Muthuganesan, N. (n.d.). Biodetergents. Retrieved 24 March 2024, from: https://www.slideshare.net/slideshow/biodetergents/215498336.
Poh, S.S. and Abdul Majid, F.D. (2011). Thermal stability of free bromelain and bromelain-polyphenol complex in pineapple juice. International Food Research Journal, 18(3), 1051-1060.
Sangkharak, K., Wangsirikul, P., Pichid, N., Yunu, T. and Prasertsan, P. (2016). Partitioning of bromelain from pineapple stem (Smooth Cayenne) by aqueous two phase system and its application for recovery and purification of polyhydroxyalkanoate. Chiang Mai Journal of Science, 43(4), 794-807.
Sawant, P. and Thumar, J. (2023). Impact of substrate pH and enzyme-substrate incubation time on protease from a new halo-tolerant Bor S17B13 found in the mangroves of Western India. Acta Scientific Microbiology, 6(3), 3-9, doi: https://doi.org/10.31080/ASMI.2023.06.1210.
Silvestre, M.P.C., Carreira, R.L., Silva, M.R., Corgosinho, F.C., Monteiro, M.R.P., Morais, H.A. (2012). Effect of pH and temperature on the activity of enzymatic extracts from pineapple peel. Food and Bioprocess Technology, 5, 1824-1831, doi: https://doi.org/10.1007/s11947-011-0616-5.
Singh, L.R., Devi, Y.R. and Devi, S.K. (2003). Enzymological characterization of pineapple extract for potential application in oak tasar (Antheraea proylei J.) silk cocoon cooking and reeling. Electronic Journal of Biotechnology, 6(3), 198-207, doi: https://doi.org/10.2225/vol6-issue3-fulltext-4.
Sivakumar, V. and Kumar, D. (2012). Leather bioprocess intensification: Ultrasound assisted novel enzymatic hair-loosening system for leather processing. Indian Journal of Biotechnology, 11(3), 326-329.
Vallés, D., Furtado, S. and Cantera, A.M.B. (2007) Characterization of news proteolytic enzymes from ripe fruits of Bromelia antiacantha bertol. (Bromeliaceae). Enzyme and Microbial Technology, 40(3), 409-413, doi: https://doi.org/10.1016/j.enzmictec.2006.07.011.
Walsh, G. (2014). Proteins: Biochemistry and biotechnology. (2nd ed). New York: John Wiley & Sons Ltd.